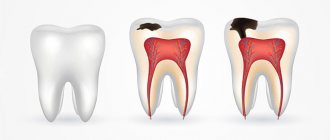
В данной статье рассмотрим синдром Стентона-Капдепона – заболевание, детерминированное на генном уровне. Проявляется повреждениями эмали и дентина, следствием чего являются не только эстетический дефект, но и в дальнейшем снижение высоты прикуса. Величина и форма зубов при прорезывании не нарушаются.
Характерен дисколорит – окрашивание эмали в сероватый или коричневый цвет. Тест анамнеза болезни, данные физикального обследования, рентгенологическое исследование и ЭОД позволяют грамотно диагностировать синдром. Его лечение обычно заключается в комплексной реминерализирующей терапии и протезировании. Разберем более подробно данный синдром.
Цели центра:
- улучшения качества долгосрочного наблюдения, планового лечения и реабилитации пациентов, перенесших вирусные инфекции, в том числе, COVID-19 и имеющих осложнения иммунопатологического характера,
- обмена научным и клиническим опытом в вышеуказанной области с российскими и зарубежными коллегами,
- диагностика и реабилитация последствий аутоиммунных заболеваний.
Лечение
В настоящее время не существует методов лечения, позволяющих избавиться полностью от какого либо миотонического синдрома. Лечение носит симптоматический характер. Если миотонические атаки становятся интенсивными, возникает необходимость применения медикаментов, позволяющих снизить симптоматику. Наиболее известным препаратом является мексилитен, а также такие препараты как гуанин, прокаинамид, тегретол, фенитоин. Но все эти препараты имеют массу побочных эффектов и поэтому их длительное употребление не желательно. Наиболее оптимально, когда пациент знает провоцирующие миотонические атаки факторы и старается по возможности избегать провоцирующих ситуаций, а после атак дает возможность мышцам восстановиться с помощью отдыха.
Задачи Центра
- Использование синергичного эффекта при объединении научного и клинического потенциала указанных подразделений СПбГУ и специалистов разного профиля (кардиоревматология, пульмонология, неврология, гастроэнтерология, эндокринология, иммунология и аллергология, психиатрия, эпидемиология) — для уточнения этиологии, патогенеза и разработки эффективных методов лечения и профилактики нарушений здоровья у лиц, перенесших новую коронавирусную инфекцию.
- Развитие внутрироссийского и международного сотрудничества в медико-биологических и клинических исследованиях постинфекционных аутоиммунных и иммунопатологических синдромов и болезней.
- Разработка индивидуализированного плана лечения для каждого пациента в сжатые сроки в рамках амбулаторных консультаций, диспансерного осмотра бригадой специалистов и стационара одного дня.
- Создание центра телемедицинских консультаций для работы с пациентами вне Санкт-Петербурга.
Постковидный синдром
– это состояние, возникающее в виде долгосрочных патологических симптомов после перенесенной новой короновирусной инфекции, сохраняющиеся на протяжении трех месяцев и более.
Причины патологии
Синдром Стентона-Капдепона – наследственное заболевание, возникающее в результате мутации гена, который отвечает за специфический матричный белок. Передаётся в 50 % случаев, как у девочек, так и у мальчиков. Заболеванию подвергаются не только временные, но и постоянные зубы.
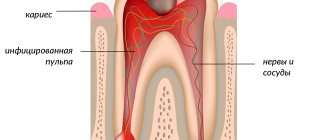
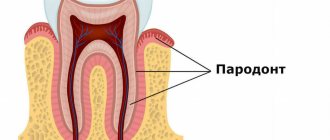
Причиной необратимых изменений является уменьшение толщины слоя эмали (дисплазия эмали и дентина), из-за чего нарушаются связи между твёрдыми тканями зуба. Обычно слой предентина отсутствует. Дентинных канальцев — меньше нормы. Продуцирование заместительного дентина приводит к облитерации пульповой камеры и кальцификации корневых каналов.
Постковидный синдром может проявляться в виде:
- общей физической слабости, головокружения,
- продолжительной субфебрильной температуры, колебания температуры тела,
- тяжести в грудной клетке,
- затруднении дыхания,
- сосудистых симптомов (васкулиты, нарушения микроциркуляторного русла),
- сердцебиения, колебания артериального давления и пульса,
- болей в суставах, мышцах,
- головных болей,
- потери и искажение обоняния и вкуса,
- нарушении пищеварения, в том числе, диарея,
- расстройстве сна,
- тревоги, панических атак,
- снижения когнитивных функций, потери памяти, «тумана в голове»
- потери волос, выпадения зубов, кистозные образования челюстей,
- расстройстве терморегуляции и пр.
Тяжесть и длительность проявлений зависит от течения инфекционного процесса. Лечение заключается в симптоматической терапии и включает в себя прием лекарственных препаратов, ЛФК и физиотерапию.
Причины
Главной причиной возникновения постковидного синдрома является перенесенная новая короновирусная инфекция. Длительность заболевания зависит от тяжести и может при легком течении составлять 2-3 недели, а при средне-тяжелом и тяжелом — 4-6 недель и более.
При данном заболевании у пациента может сохранятся определенная симптоматика, которую исследователи связывают с:
- сохраняющимся воспалительным процессом,
- возможным длительным нахождением вируса SARS-CoV-2 в организме,
- развитием вегетативной дисфункции,
- хроническим стрессом обусловленным изменением образа жизни (введением карантинных мероприятий).
Лечение дисплазии
На сегодняшний день медицина не располагает методами, которые могли бы позволить пациентам навсегда избавиться от всех проявлений дисплазии зубов. Основной целью лечения данной патологии является максимальное сохранение твердых зубных тканей от разрушения путем проведения следующих лечебных манипуляций:
- пломбирования;
- реминерализирующей терапии;
- художественной реставрации зубов;
- витаминотерапии.
При отсутствии ожидаемого эффекта от проводимого лечения, а также при существенной убыли твердых зубных тканей производится протезирование зубов с использованием самых современных и эффективных протезных приспособлений.
Не затягивайте с лечением, обращайтесь в круглосуточную стоматологию «А.Дент» и наши врачи окажут вам достойное лечение.
Патогенез
Механизм возникновения постковидного синдрома малоизучен и, предположительно, связан со морфологической структурой и свойствами вируса и его воздействием на ткани и органы человека.
Одной из причин называют тропность вируса к эндотелию сосудов нервной, почечной, легочной ткани и способностью вызывать в ней хронический васкулит с развитием тромбоэмболии, тканевой гипоксии и ишемии органов.
Нельзя исключить развитие патологического иммунного ответа, приводящего к развитию хронического аутоиммунного воспаления, поражающего органы и системы человека.
Отдельно следует учитывать влияние вируса SARS-CoV2 на развитие вегетативной дисфункции, что клинически проявляется в нарушении функции сердечно-сосудистой системы, желудочно-кишечного тракта, дыхательной и нервной системы.
Наследственные дисплазии эмали
Под несовершенным амелогенезом понимается генетически обусловленная патология, при которой нарушается структуры эмали. Заболевание развивается еще на стадии закладки эктодермальных листов, из которых в дальнейшем формируется костная структура, кровеносные сосуды и ряд внутренних органов.
Несовершенный амелогенез чаще диагностируют у женщин. Этот факт обусловлен тем, что аномальное развитие зубов данного типа провоцирует нарушение других структур, вследствие чего происходит гибель плода мужского пола.
Впервые аномалия проявляется у детей, когда начинается рост молочных зубов. Последние имеют нехарактерную для себя структуру с истонченной эмалью, которая приобретает желтый или коричневый оттенок.
Провоцирующие факторы
Несовершенный амелогенез развивается посредством передачи мутатного материала (гена амелогенина) через Х-хромосому или аутосому. Данные изменения приводят к формированию тонких кристаллов, из которых в дальнейшем образуется зубная эмаль.
На развитие дисплазии эмали влияют также мутации других генов. В частности, из-за несовершенства ММР-20, нарушается ферментация кальций-зависимой протеиназы. Последняя отвечает за формирование матрикса эмали.
Типа эмалевой дисплазии
В медицинской практике принято выделять четыре типа амелогенеза:
- Гипопластический. Он возникает еще на стадии закладки зубных тканей. Гипопластический тип характеризуется нарушением функций амелобластов.
- Гипоматурация. Возникает на фоне нарушения процесса формирования эмали. В данном случае сохраняется нормальная толщина зубной эмали. Однако в ней наблюдается недостаток минеральных веществ.
- Гипокальцификационный. Развивается вследствие сбоя процесса минерализации зубной эмали. Для данного типа характерен активный рост кристаллитов. В результате данная аномалия приводит к снижению объема минералов в эмали.
- Гипоматурация с гипоплазией. Интенсивность симптоматики определяется суммированием признаком обеих патологий.
Особенности симптоматики
Вне зависимости от типа заболевания оно сопровождается следующими проявлениями:
- истончение эмали;
- потемнение ее поверхности;
- формирование углублений на зубах, расположенных около щек;
- частичное или полное стирание эмали и дентина.
Гипопластический тип заболевания характеризуется:
- потемнением эмалевой поверхности;
- задержкой в прорезывании зубов;
- снижением высоты прикуса;
- смещением головки, относящейся к височно-нижнечелюстному суставу.
При гипоматурационном типе наблюдаются:
- низкая рентгеновская плотность эмали, вызванная малым содержанием в ней минералов;
- верхние части зуба покрываются небольшими точками или полосами.
Гипокальцификационный тип протекает в сопровождении следующих явлений:
- эмаль становится мягкой, что приводит к ее отслаиванию;
- появление частых сколов на поверхности зубов;
- теряется блеск зубов.
Из-за того, что амелогенез приводит к истончению эмали, вследствие ее постепенного разрушения, зубы приобретают различные аномальные формы.
Что предлагает современная медицина?
Лечение несовершенного амелогенеза занимает около одного года. При таком заболевании показаны:
- аппликации с препаратами, содержащими фтор и кальций, эта процедура повторяется каждые три месяца;
- применение казеин фосфопротеида и аморфного кальция фосфата;
- реставрация и протезирование зубов в случае диагностирования значительных повреждений.
Добиться положительного эффекта также позволяет своевременное лечение, в ходе которого проблемные зубы покрываются коронками.
Симптомы
Единой картины и клинических проявлений постковидного синдрома не существует. Некоторые пациенты отмечают те же проявления, что и во время болезни, а у других возникают новые симптомы. К наиболее часто встречающимся симптомам относят:
- постоянную утомляемость,
- нарушение циркадных ритмов (сон и бодрствование),
- периодический субфебрилитет или гипотермия,
- боль, заложенность, тяжесть в грудной клетке,
- кашель и нехватка воздуха,
- раздражительность, плаксивость, тревожность,
- головные боли,
- боли в сердце, нарушения ритма сердца,
- гипер- или гипотензия,
- выпадение волос,
- нарушение чувствительности кожи,
- нарушение слуха и обоняния,
- расстройство пищеварения,
- потеря концентрации внимания и памяти.
Симптоматика
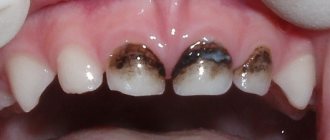
Синдром Стентона-Капдепона не мешает зубам прорезаться в срок. Раннее или позднее появление встречается редко. Характерным симптомом заболевания является цвет эмали – от жёлтого до серого и коричневого. Он возникает из-за заполнения кровью дентинных трубочек. Скалываясь, эмаль обнажает поверхность дентина.
Увеличение содержания воды и снижение минеральных составляющих разрушает структуру дентина, что влияет на повышенную стираемость зубов. Сниженный прикус уменьшает нижнюю треть лица. Из-за сколов эмали становятся острыми края зубов, вследствие чего возникают болезненные повреждения слизистой. Для чего применяют стеклоиономерный цемент? Об этом далее.
Диагностика
Диагностировать постковидный синдром может терапевт, кардиолог или невролог, в зависимости от причины обращения и симптоматики проявления. Пациенту могут быть назначены следующие обследования:
- Лабораторная диагностика.
Включает в себя проведение количественного и качественного анализа иммуноглобулинов классов M и G к SARS-CoV-2. Возможно проведение клинического и биохимического анализов крови, а также коагулограммы.
- Инструментальная диагностика.
К исследованиям, назначаемым при данных нарушениях, могут относится: ЭКГ, эхокардиограмма, суточное мониторирование ритма сердца по Холтеру, лазерная допплеровская флоуметрия, активная ортостатическая проба, ольфакторный тест, электроэнцефалограмма. При прочих жалобах в зависимости от симптоматики могут быть назначены МРТ или УЗИ органов брюшной полости, малого таза. УЗДС вен или артерий.
- Психодиагностика
. Больным с тревожными и депрессивными симптомами, когнитивными нарушениями необходима консультация клинического психолога или психотерапевта.
Кардиоренальный синдром: этиология, диагностика, терапия.
В соответствии с исследованиями, проведёнными в странах Европы и США, частота распространенности ХСН в популяции варьирует от 0, 4 до 2% и значительно возрастает у лиц старше 60 лет, достигая 10% [1].
Что касается Российской Федерации, то по данным И. В. Фомина и соавт. в Европейской части страны ХСН страдает 8, 9% всего населения и 54% у лиц старше 80 лет [2].
Таким образом, прогноз у пациентов с ХСН крайне неблагоприятный, смертность среди данной группы пациентов в 4-8 раз выше, чем в общей популяции того же возраста [3, 4, 5].
Дальнейшее изучение проблемы ХСН показало, что одновременное ухудшение функции почек утяжеляет течение заболевания и значительно увеличивает риск летального исхода. Этот риск становится более выраженным при повышении уровня креатинина в сыворотке крови выше 1, 3 мг/дл и при снижении скорости клубочковой фильтрации (СКФ) ниже 60 мл/мин [6, 7].
Таким образом, почки рассматриваются не только как орган, способствующий развитию отёчного синдрома, но и прогрессированию ХСН. Почки задерживают Na+ и воду, увеличивают преднагрузку, активируют ренин-ангиотензин-альдостероновую систему (РААС), что приводит к развитию гипертрофии миокарда с последующей дилатацией левого желудочка. Сосуществование двух патологических процессов у одного пациента послужило основанием для объединения их в единый термин, получивший название кардиоренальный синдром (КРС) [8].
В настоящее время КРС – это патологические взаимообусловленные состояния с вовлечением сердца и почек, развивающиеся вследствие острой или хронической дисфункции одного из органов с последующей острой или хронической дисфункцией другого.
На сегодняшний момент существует классификация КРС, состоящая из 5 типов, в зависимости от патофизиологических и временных рамок развития кардиальной и почечной недостаточности. КРС может быть представлен как состояние, при котором в результате острой или хронической дисфункции одного органа происходит острая или хроническая дисфункция другого органа [9].
КРС 1-го типа – это внезапное, острое ухудшение сердечной деятельности, которое приводит к острому повреждению почек (ОПП). КРС 1-го типа встречается при остром коронарном синдроме в 9-19% случаев [10]. Острая декомпенсация ХСН осложняется ОПП в 24-45% случаев [11, 12]. Клинические и лабораторные проявления ОПП как правило развиваются в первые 4 суток (50% случаев) или в течение 7 суток (70-90% случаев) [13].
КРС 2-го типа характеризуется наличием у пациента ХСН, которая с течением времени приводит к формированию и прогрессированию хронической болезни почек (ХБП). Частота ХБП среди пациентов с ХСН может составлять 45-63, 6% и является плохим прогностическим фактором сердечно-сосудистой смерти [14, 15].
КРС 3-го типа или острый ренокардиальный синдром включает в себя первичное и острое нарушение функции почек в результате острого гломерулонефрита, пиелонефрита или острого канальцевого некроза. В свою очередь ОПП вызывает сердечную недостаточность, аритмию и ишемию миокарда. ОПП наиболее часто встречается у пациентов, находящихся в отделениях интенсивной терапии (35%) [16].
КРС 4-го типа характеризуется ХБП, которая приводит к ХСН. Частота распространённости ХБП, во всём мире в течение последнего времени увеличивается и достигает 10-15%. В настоящее время основной причиной ХБП является сахарный диабет, артериальная гипертензия, атеросклероз и ожирение, то есть заболевания, которые наиболее часто встречаются в развитых странах. Риск смерти у пациентов с ХБП от сердечно-сосудистых заболеваний увеличивается в 10-20 раз по сравнению с пациентами без ХБП [17, 18].
КРС 5-го типа – это сочетание кардиальной и почечной патологии в результате острого повреждения, при котором нарушение функции одного органа влияет на функцию другого органа. Наиболее часто КРС 5-го типа развивается у септических пациентов. Сепсис является наиболее частым состоянием, которое вызывает нарушение функции миокарда и почек [19, 20].
КРС была представлена A. Guyton (1990) в виде гемодинамической модели. Согласно данной модели почки контролируют внепочечную жидкость путём регуляции процессов экскреции и реабсорбции Na+, а сердце контролирует системную гемодинамику [21]. Центральное место отводится РААС, натрийуретическому пептиду (НУП) и каллекреин-кининовой системе. В результате поражения одного из органов происходит активация РААС и симпатической нервной системы, развивается дисфункция эндотелия, хроническое воспаление. В результате образуется порочный круг, в котором сочетание кардиальной и почечной дисфункции приводит к ускоренному снижению функциональной способности каждого из органов.
Патогенез КРС зависит от типа синдрома. При КРС 1-го типа ОПП возникает в результате снижения сердечного выброса, что приводит к нарушению перфузии почек. Достаточно часто развивается резистентность к диуретической терапии. Попытки купировать отёчный синдром или ОПП путём увеличения дозы или комбинацией диуретических препаратов может являться дополнительным фактором прогрессирования ОПП.
В основе патогенеза КРС 2-го типа лежит длительная гипоперфузия почек и активация вазоконстрикторов, таких как адреналин, ангиотензин и эндотелин.
При КРС 3-го типа в результате ОПП возникает гипергидротация, которая может приводить к отёку лёгких и гиперкалиемия, способствующая возникновению аритмии и остановки сердца.
Ранняя диагностика КРС позволяет своевременно начать лечение, предупредить развитие осложнений и снизить летальность. В настоящее время большое значение отводится определению биомаркеров заболевания. Биомаркер должен выявляться на ранних стадиях заболевания, указывать на время и тяжесть повреждения, обладать высокой чувствительностью, специфичностью и позволять прогнозировать течение заболевания.
Биомаркером, который определяется на ранних этапах ОПП, является ассоциированный с нейтрофильной желатиназой липокаин (NGAL – neutrophil gelatinase-associated lipocalin), появление которого опережает повышение креатинина на 48-72 часа [22, 23].
В соответствии с данными представленными R. G. VandeVoorle (2006) цистатин С коррелирует с длительностью и тяжестью ОПП, потребностью пациентов в заместительной почечной терапии (ЗПТ) и госпитальной летальностью [24].
Молекула почечного повреждения (KIM-1 – kidney injury molecule) – белок, который обнаруживается в моче после ишемического или токсического повреждения проксимальных канальцев. KIM-1 относится к важным и высокочувствительным биомаркером ранних стадий ОПП [25].
Кроме вышеперечисленных биомаркеров, в научных публикациях можно встретить упоминание о интерлейкине-18, лизосомальном ферменте N-ацетил-β-d-глюкозаминидазе, которые позволяют диагностировать ОПП [26].
Что касается диагностики острого повреждения миокарда, то необходимо отметить НУП, который обнаруживается при острой сердечной недостаточности или декомпенсации ХСН [13, 27].
Общепризнанным маркером некроза миокарда является тропонин. Повышение уровня тропонина ассоциируется с увеличением смертности при ХБП и имеет прогностическое значение для КРС 4-го типа [20].
Маркерами прогрессирования ХБП в настоящее время является микроальбуминурия, протеинурия, уровень С-реактивного белка и снижение СКФ [28].
Креатинин сыворотки крови является простым, но важным показателем, позволяющим определить выживаемость пациентов с ХСН. Согласно результатам, представленным G. I. Smith et al. (2003) повышение концентрации креатинина сыворотке за период госпитализации на 0, 2 мг/дл и более повышает риск смерти в течение последующих 6 месяцев на 67% и вероятность повторной госпитализации на 33% [12].
Терапия КРС включает в себя следующие мероприятия: назначение диуретиков, ингибиторов АПФ, нитратов и сердечных гликозидов.
Следует отметить, что длительная терапия КРС, в частности применение диуретиков может приводить к снижению их эффективности и формированию рефрактерного к медикаментозной терапии состояния [29, 30].
Одним из эффективных методов лечения тяжёлого, рефрактерного к медикаментозной терапии КРС является применение методов ЗПТ. Методы ЗПТ, в частности ультрафильтрация (УФ), гемодиализ (ГД), гемофильтрация (ГФ), гемодиафильтрация (ГДФ) широко применяются в нефрологической практике и в терапии критических состояний. Одним из компонентов ГД, ГФ, ГДФ является УФ, то есть удаление жидкости. В ряде исследований отмечается эффективность УФ как метода выбора в лечении тяжелого КРС [31, 32, 33, 34, 35].
Положительный эффект УФ как компонента ЗПТ обусловлен устранением гипергидротации, уменьшением нагрузки на сердце за счёт снижения венозного возврата, что в конечном итоге отражается на улучшении сократительной функции сердца. Хорошая переносимость сеансов обусловлена поддержанием стабильности электролитного состава и осмолярности плазмы, что обеспечивает адекватный приток интерстициальной жидкости в сосудистое русло. Методики ЗПТ позволяют немедленно начать извлечение жидкости из организма, удалять её с заданной скоростью и в нужном объеме [36, 37].
Немаловажным моментом является способность ЗПТ снижать концентрацию мочевой кислоты (МК) в сыворотке крови. У наблюдаемых пациентов, как было отмечено выше, определялся повышенный уровень МК. Данные, приведенные С. Р. Гиляревским, показывают связь между уровнем МК и риском утяжеления течения КРС и как следствие вероятным неблагоприятным исходом течения основного заболевания [38]. С другой стороны повышение уровня МК может провоцироваться применением высоких доз фуросемида. Это в конечном итоге может создавать предпосылки для формирования уратного блока, что в свою очередь может усугублять функцию и без того скомпрометированных почек. ЗПТ устраняет этот компонент, способный утяжелить течение КРС. Нормализация уровня МК в определенной степени способствует нормализации темпа диуреза.
Применение одной из методики ЗПТ – УФ в терапии КРС описывает M. R. Costanzo et al. [39]. В работе приводятся результаты многоцентрового рандомизированного исследования по сопоставлению эффективности УФ с внутривенным введением диуретиков у пациентов с острой декомпенсацией ХСН. В группе, где использовалась УФ, было достигнуто большее удаление жидкости, что приводило к более значимому снижению веса по сравнению с группой, где применялись только диуретики. Через 90 суток в группе, где проводилась УФ повторная госпитализация наблюдалась только в 18% случаев против 32% в группе, где использовались только диуретики [34].
В заключение следует отметить, что в последние годы появилась «гибритная» методика, получившая название медленный низкоэффективный ежедневный диализ (SLEDD). Данный метод позволяет предотвратить быстрого колебания концентрации веществ и/или снижение внутрисосудистого объёма за счёт более длительного времени проведения сеанса, превышающего 4 часа. Дело в том, что пациенты с ХСН перегружены жидкостью, которая накапливается в третьем пространстве (асцит, гидроперикард, гидроторакс). Однако в действительности у данных пациентов возникает дисбаланс в распределении жидкости в организме, при котором в сосудистом русле достаточно часто отмечается гиповолемия. При проведении УФ дисбаланс между распределением жидкости в организме может привести к гипотонии. Применение методики SLEDD позволяет сохранить гемодинамическую стабильность за счет низкой скорости УФ. Кроме этого во время сеансов SLEDD сохраняется адекватный клиренс низкомолекулярных водорастворимых веществ и отсутствуют тяжёлые электролитные нарушения [40, 41].
КРС в последние годы встречается достаточно часто. Это связано с прогрессивным увеличением сердечно-сосудистой патологии, сахарного диабета, ожирения и увеличения продолжительности жизни населения. Развитие КРС при ХСН усложняет лечение и значительно ухудшает прогноз течения заболевания. Вероятно, что ухудшение функции почек является ключевым фактором, приводящим к декомпенсации ХСН. На определённом этапе прогрессирования ХСН почки становятся даже более важным органом мишенью, чем сердце. Таким образом, главным направлением лечебной стратегии ХСН и КРС является создание нефропротективной терапии, которая позволит замедлить прогрессирование патологии, увеличить продолжительность и качество жизни пациентов ХСН.
Список литературы
- Резник Е. В. , Строжаков Г. И. , Гендлин Г. Е. Болеет сердце-страдают почки: кардиоренальный синдром у больных с хронической сердечной недостаточностью. Лечебное дело 2009; 1: 27–35.
- Фомин И. В. , Беленков Ю. Н. , Мареев В. Ю. и др. Распространенность ХСН в Европейской части Российской Федерации – данные ЭПОХА-ХСН. Серд. недостат 2006; 1 (35): 4–8.
- Агеев Ф. Е. , Скворцов А. А. , Мареев В. Ю. и др. Сердечная недостаточность на фоне ишемической болезни сердца: некоторые вопросы эпидемиологии, патогенеза и лечения. Рус. мед. журн 2000; 15/16: 622–626.
- Heywood J. T. The cardiorenal syndrome: Lessons from the ADHERE data base and treatment options. Heart Fail. Rew 2004; 9: 195–201.
- Mc Alister F. A. , Ezekowitz J. , Tonelli M. et al. Renal insufficiency and heart failure: prognostic and therapeutic implications from a prospective cohort study. Circulation 2004; 109: 1004–1009.
- Dries D. L. , Exner D. V. , Domanski M. J. et al. The prognostic implications of renal insufficiency in a symptomatic and symptomatic patients with left ventricular systolic dysfunction. J. Am. Coll. Cardiol 2000; 35: 681–689.
- Mahan N. G. , Blackstone E. H. , Francis G. S. et al. The prognostic value of estimated creatinine clearance alongside functional capacity in patients with chronic congestive heart failure. J. Am. Coll. Cardiol 2002; 40: 1106–1113.
- Ronco C. Cardiorenal and renocardial syndromes: clinical discorders in search of a systematic definition. Int. J. Artif. Organs 2008; 31: 1–2.
- Ronco C. , Haapio M. , House A. A. et al. Cardiorenal syndrome. J. Am. Coll 2008; 52: 1527–1539.
- Latchamsetty R. , Fang J. , kline-Rogers E. et al. Prognostic Value of Treatment and Sustained Increase in In-Hospital Creatinine on Outcomes of Patients Admited With Acute Coronary Syndrome. Am. J. Cardiol 2007; 99 (7): 939–942.
- Cowie M. R. , Komajda M. , Murray-Thomas T. et al. Prevadence and impact of worsening renal function in patients hospitalized with decompensated heart failure: results of the prospective outcomes study in heart failure (POSH). E. H. J 2006; 27: 1216–1222.
- Smith G. L. , Vaccarino V. , Kasiborod M. et al. Worsening renal function: What is a clinicaly meaningful change in creatinine during hospitalization with heart failure? J. Card. Fail 2003; 9: 13–25.
- Ronco C. , Bellomo R. , McCullough P. A. Cardiorenal Syndrome in Critical Care. Contr. Nephrol 2010; Based Karger 2010; 165
- Ahmed A. , Rich M. W. , Sanders P. W. et al. Chronical Kidney Disease Associated Mortality in Diagnostic Versus Systolic Heart Failure: A Propensity Matched Study. Am. J. Cardiol 2007; 99: 393–398.
- Campbell R. C. , Sui S. , Flippatos G. et al. Association of chronic kidney disease with outcome in chronic heart failure: a propensity-matched study. Nephrol. Dial. Transplant 2009; 24: 186–193.
- Roghi A. , Savonitto S. , Cavallini C. et al. Impact of acute renal failure following percutaneous coronary intervention on long-term mortality. J. Cardiovasc. Med 2008; 9: 375–381.
- Coresh I. J. , Stevens L. , Levery A. Chronic kidney disease is common: What do we do next? Nephrol. Dial. Transplant 2008; 23 (8): 1122–1125.
- McClellan W. The epidemic of renal disease – what drives it and what can be done? Nephrol. Dial. Transplant 2006; 21 (6): 1461–1464.
- Bagshaw S. M. , Lapinsky S. , Dial S. et al. Acute kidney injure in septic shock: clinical outcome and impact of duration of hypotension prior to initiation of antimicrobial therapy. Intensive Care Med 2009; 35: 871–881.
- Ammann P. , Maggiorini M. , Bertel O. et al. Troponin as a risk factor for mortality in critically ill patients without acute coronary syndromes. J. Am. Coll. Cardiol 2003; 41: 2004–2009.
- Bongartz L. G. , Cramer M. J. , Doevendans P. A. et al. The severe cardiorenal syndrome. Eur. Heart. J 2005; 26: 11–17.
- Han W. K. , Bonvente J. V. Biologic markers for the early direction of acute kidney injure. Curr. Opin. Crit. Care 2004: 10: 476–482.
- Ronco C. NGAL: an emerging biomarker of acute kidney injure. Int. J. Artif. Organs 2008; 11: 199–200.
- VandeVoorde R. G. , Katlman T. I. , Ma Q. et al. Serum NGAL and cystain C as predictive biomarkers of acute kidney injure. J. Am. Soc. Nephrol 2006; 17: 404A.
- Parkh C. R. , Devarajan P. New biomarkers of acute kidney injure. Crit. Care Med 2008; 36 (Suppl. 4): 159–165.
- Кобалава Ж. Д. , Ефремовцева М. А. , Виллевальде С. В. Кардиоренальные синдромы. Клин. нефрол 2011; 6: 9–15.
- Austin W. J. , Bhalla V. , Hernandez-Arce I. et al. Crrelation and prognostic utility of B-type natriuretic peptide and its aminoterminal fragment in patients with chronic kidney disease. Am. J. Clin. Pathol 2006; 126: 506–512.
- Chadban S. J. , Briganti E. M. , Kerr P. G. et al. Prevalence of kidney damage in Australian adult: The usDiab kidney study. J. Am. Soc. Nephrol 2005; 14 (Suppl. ): 131–138.
- Geisbery C. , Butlet J. Addressing the challenges of cardiorenal syndrome. Clew. Clin. J. Med 2006; 73: 485–491.
- Liang K. V. , Williams A. W. , Greene E. L. et al. Acute decompensated heart failure and the cardiorenal syndrome. Crit. Care Med 2008; 31 (1Suppl): 75–88.
- Jaski B. E. , Miller D. Ultrafiltration in decompensated heart failure. Curr. Heart Fail Rep 2005; 2: 148–158.
- Wertman B. M. , Gura V. Ultrafiltration for the Management of Acute Decompensated Heart Failure. J. Card. Fail 2008; 14: 754–759.
- Marenzi G. , Lauri G. , Grazi E. et al. Circulatory response to fluid overload removal by extracorporeal ultrafiltration in refractory congestive Heart Failure. J. Am. Col. Cardiol 2001; 38 (4): 963–968.
- Costanzo M. R. , Saltzberg M. , O’Sullivan J. et al. Early ultrafiltration in patients with decompensated Heart Failure and diuretic resistanse. J. Am. Col. Cardiol 2005; 46 (11): 2047–2051.
- Udani S. M. , Murray P. T. Тhe use of renal replacement therapy in acute decompensated heart failure. Semin. Dial 2009; 22 (2): 173–179.
- Violi F. , Nacca R. G. , Lengo G. et al. Long-term sustained low efficiency dialysis in eight patients with class IV NYHA heart failure resistant to high-dose diuretic treatment. G. Ital. Nefrol 2009; 26 (Suppl. 46): 50–52.
- Hillege H. L. , Nitsch D. , Pfeffer M. A. Renal function as a predictor of outcome in a broad spectrum of patients with heart failure. Circulation 2006; 113: 671–678.
- Гиляревский С. Р. Гиперурикемия и хроническая сердечная недостаточность: существует ли причинно-следственная связь? Клин. нефрол 2010; 5: 18–22.
- Costanzo M. R. , Guglin M. E. , Saltzberg M. T. et al. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. J. Am. Coll. Cardiol 2007; 49: 675 – 683 (Erratum in 2007; 49: 1136).
- Унароков З. М. , Мухоедова Т. В. Заместительная почечная терапия в лечении диуретик-рефрактерных отеков у больных с кардиоренальным синдромом. Сб. матер. «Акт. аспекты экстракорпорального очищения крови в интенсивной терапии». М 2010: 27.
- Бокерия Л. А. , Ярустовский М. Б. Руководство по экстракорпоральному очищению крови в интенсивной терапии. М.: НЦССХ им. А. Н. Бакулева РАМН, 2009 – 486с.
Лечение постковидного синдрома
При выявлении лечащим врачом подозрения на имеющийся у пациента пост-ковидный синдром рекомендуется консультация в центре. Лечащий врач при отрицательных анализах на вирус SARS-CoV2 направляет пациентов или пакет документов на отборочную комиссию в указанный центр. Отборочная комиссия согласует амбулаторную консультацию в Центре, оформляет первичную смежную документацию. При наличии показаний, после проведения амбулаторной консультации, пациенту может быть рекомендована госпитализация в стационар одного дня для проведения дальнейших исследований и получения терапии. Лечащий врач Центра приглашает пациентов на дальнейшее лечение и реабилитацию. При необходимости, устанавливается диспансерное наблюдение, проводится санпросветработа, повышающая информированность пациентов о данном заболевании и увеличивающая мотивацию к лечению и реабилитации.
Лечение включает в себя симптоматическую фармакотерапию, физическую реабилитацию и ЛФК, физиотерапию.
Как может помочь протезирование?
Протезирование является оптимальным методом восстановления функции и эстетики зубов. Цельнолитые коронки изготавливают на боковые зубы, фронтальные — покрываются металлокерамическими коронками. Также протезирование может проводиться методом виниринга, ламинирования передней группы зубов и щечных поверхностей с применением керамических накладок. При переломе корня зуба или при плохой эффективности эндодонтической терапии зуб удаляется. Чтобы заместить дефекты зубных рядов, зачастую применяют съемные протезы зубов.