Бесплатные вебинары по антивозрастной медицине Узнайте об особенностях Международной школы Anti-Age Expert, а также о возможностях для совершенствования врачебной практики изо дня в день. Также в программе вебинаров — увлекательные обзоры инноваций в антивозрастной медицине и разборы сложнейших клинических случаев с рекомендациями, которые действительно работают
Узнать подробнее
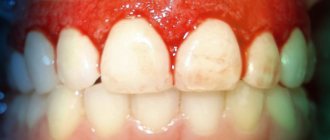
Кариес
Согласно исследованию, опубликованному в медицинском журнале The Lancet, кариес есть у 2,83 миллиардов взрослых и детей во всем мире.
Кариозные полости обычно образуются, когда бактерии в зубном налете соединяются с сахаром, образуя кислоту, разрушающую эмаль.
Лечение:
если вы или ваш стоматолог обнаружите кариес на достаточно ранней стадии, вы сможете обратить процесс вспять с помощью фторсодержащих препаратов. В противном случае предусматривается классическое лечение кариеса — пломбирование.
Однако, если кариес настолько разрастается, что пломба не помогает, стоматолог может покрыть зуб коронкой или удалить его. Опять же, раннее обнаружение может предотвратить разрушение и потерю зубов.
Заболевания десен
Некоторые формы заболеваний десен, также называемые пародонтозом или пародонтитом, поражают почти половину взрослых в возрасте 30 лет и старше. Степень тяжести варьируется от умеренно опухших десен до кровоточивости десен и полной потери зубов.
Большинство заболеваний десен развиваются в несколько этапов:
- Зубной налет и зубной камень на зубах, что приводит к гингивиту (воспалению десен).
- Гингивит раздражает мягкие ткани вдоль линии десен, что постепенно приводит к пародонтиту.
- Пародонтит возникает, когда десна отделяется от зубов, образуя карманы. Это может привести к дальнейшей инфекции десен, требующей лечения антибиотиками, хирургического вмешательства или удаления зуба.
Лечение:
как и кариес, заболевание десен в стадии гингивита хорошо поддается лечению, если его выявить на ранней стадии. Если это невозможно исправить, ваш стоматолог, скорее всего, предложит удаление зубного камня, профессиональную глубокую очистку, чтобы удалить весь налет изо рта. Как уже отмечалось, также могут быть назначены антибиотики. При запущенном пародонтите может потребоваться операция.
«Заболевания пародонта, это действительно, часто встречающаяся проблема. Если не лечить такие заболевания, то рано или поздно это приводит к образованию глубоких и болезненных пародонтальных карманов, а в конечном итоге и к выпадению зубов. Помимо этого, микрофлора, которая живет во рту, очень агрессивная. Попадая в кровоток, она может распространяться и осложнять течение хронических заболеваний суставов, сердца, легких, головного мозга, вызывать сбой в их работе. Доказана взаимосвязь между наличием патогенной микрофлоры полости рта и такими заболеваниями, как болезнь Альцгеймера и Паркинсона. Попадание в легкие при кашле, зубного налета или содержимого пародонтальных карманов может ухудшать прогноз любых ОРВИ, а также утяжелять течение COVID-19. Поэтому так важно следить за состоянием пародонта, проходить каждые 6 месяцев профилактические осмотры, проводить проф. гигиену полости рта, снимать зубные отложения, как твёрдые, так и мягкие. При диагностике заболеваний дёсен — обязательно проводить своевременное лечение. Для профилактики важно использовать в домашних условиях простые способы ухода — чистка зубов качественной зубной пастой — 2 раза в день, а также использовать для дополнительной гигиены зубные нити, ирригаторы, специальные ополаскиватели.»
Калашникова Оксана Юрьевна
врач-стоматолог, имплантолог-ортопед, гнатолог, челюстно-лицевой хирург, специалист по эстетической стоматологии, кандидат медицинских наук, врач высшей категории, врач интегративной междисциплинарной антивозрастной медицины Стаж работы: 30 лет
Использованная литература
- Помазанов, В.В. Микроэкологический статус человека и его определение. — Перспективы внедрения инновационных технологий в медицине и фармации, 2022. — С. 167-184.
- Гострый, А.В., Симонова, А.В., Михайлова, А.Н. и др. Хронический фарингит: этиология, патогенез, лечение. Новые подходы к оценке этиопатогенеза. — Архивъ внутренней медицины, 2022. — №1(45). — С.32-43.
- Man, W., Clerc, M., Piters, W. et al. Loss of microbial topography between oral and nasopharyngeal microbiota and development of respiratory infections early in life. – American journal of respiratory and critical care medicine, 2022. — Vol. 200(6). — P. 760-770.
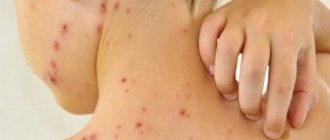
Инфекционные заболевания
Инфекция полости рта приводит к развитию заболевания, при котором воспаляются слизистые оболочки. Патологический процесс может захватить зубы и десны. Симптомы инфекций во рту часто бывают скрытыми, но рано или поздно проявляются.
Онлайн обучение Anti-Age медицине Изучайте тонкости антивозрастной медицины из любой точки мира. Для удобства врачей мы создали обучающую онлайн-платформу Anti-Age Expert: Здесь последовательно выкладываются лекции наших образовательных программ, к которым открыт доступ 24/7. Врачи могут изучать материалы необходимое количество раз, задавать вопросы и обсуждать интересные клинические случаи с коллегами в специальных чатах
Узнать подробнее
Причины инфекционных заболеваний слизистых оболочек рта:
- Неконтролируемый прием лекарств.
Лечение любого заболевания должно проходить под контролем врача. Неправильное применение антибиотиков, антибактериальных и других средств приводит к последствиям, в том числе, в виде заболеваний полости рта.
- ВИЧ и СПИД.
Инфекционные заболевания слизистых оболочек полости рта часто возникают на их фоне.
- Возникновение инфекций в полости рта
может быть связано с ослаблением иммунной системы.
- Неправильное питание.
Если на слизистую действует агрессивная пища, это травмирует ее. Таким образом, слизистая оболочка становится более уязвимой и подверженной инфекции.
Кроме того, провокатором заболеваний полости рта являются курение и алкоголь. С подобными проблемами сталкиваются также те, чей организм страдает обезвоживанием или испытывает гормональный дисбаланс.
- Стоматит.
Во рту обитает множество бактерий, и за счет снижения иммунитета они активизируются. Таким образом, развивается инфекционное заболевание. Одно из самых распространенных — стоматит. Обычно он развивается у людей, которые неправильно или недостаточно тщательно чистят зубы. Заболевание также может возникнуть из-за тонзиллита или заболеваний желудочно-кишечного тракта. Существует несколько видов стоматита:
- Катаральный.
Он проявляется отеком слизистой оболочки рта. По мере прогрессирования катарального стоматита на языке появляется зубной налет.
- Язвенный.
В этом случае увеличиваются лимфатические узлы. Такой стоматит проявляется головокружением и слабостью. Может возникнуть у людей с язвой желудка, энтеритом.
- Афтозный стоматит.
Приводит к повреждению слизистой оболочки рта, на поверхности которой образуются эрозии. Афтозный стоматит связан с нарушением баланса желудочно-кишечного тракта. Признаки афтозного стоматита: отек слизистой оболочки рта, недомогание, эрозии во рту.
- Заболевания, вызванные вирусами.
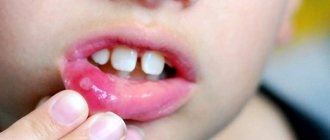
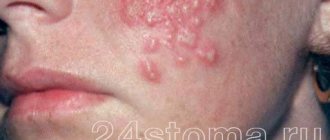
Самым известным инфекционным заболеванием полости рта является герпес, клинически известный как вирус простого герпеса 1 типа (ВПГ-1). Он часто обнаруживается у детей в возрасте от 6 месяцев до 5 лет.
Как только ВПГ-1 попадает в организм ребенка, он будет носителем вируса на протяжении всей своей жизни. По оценкам, 50-80 % взрослых живут с простым герпесом — в спящей или активной стадии.
Вирус герпеса проявляется высыпаниями вокруг рта. По мере прогрессирования заболевания во рту образуются язвы: они локализуются на внутренней стороне губ и щек. Герпес также может инфицировать ткани, расположенные возле зубов.
После первого приступа орального герпеса в организме вырабатываются антитела для борьбы с вирусом и его последствиями. Таким образом, ваши последующие вспышки ВПГ-1 могут быть не такими серьезными или вирус останется в спящем состоянии.
В противном случае может помочь прием противовирусных препаратов.
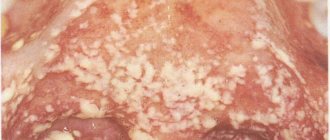
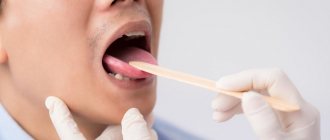
- Кандидоз.
Это проявление грибковой инфекции. Микроорганизмы грибка кандида обитают во рту и активизируются под действием неблагоприятных факторов. Кандидоз появляется у людей с ослабленной иммунной системой. Чтобы избежать болезни, необходимо укреплять иммунитет, избегать переохлаждений. Выделяют несколько видов кандидоза:
- Псевдомембранозный.
Проходит в острой форме. По мере прогрессирования патологии слизистая щёк начинает сохнуть, то же самое происходит с губами и языком. На языке образуется налет творожной консистенции. Псевдомембранозный кандидоз вызывает дискомфорт при жевании и зуд. Заболевание может возникнуть у людей с ослабленной иммунной системой, а также на фоне патологий крови. Другие причины псевдомембранозного кандидоза — сахарный диабет и гиповитаминоз.
- Атрофический кандидоз.
В этом случае слизистая оболочка рта становится красной и сухой. Хроническая форма заболевания развивается у тех, кто длительное время пользуется зубными протезами.
- Гиперпластический кандидоз
может быть острым или хроническим. При хроническом течении на слизистых образуется налет, в том числе, на языке. При попытке удалить его, слизистая оболочка воспаляется сильнее. Чистка зубов может вызвать кровотечение.
- Заболевание, возникающее на фоне ВИЧ.
Вторичный иммунодефицит характеризуется активным размножением патогенной флоры в полости рта. Ранняя диагностика позволит быстрее начать лечение и улучшить прогноз иммунодефицита.
Важно отметить, что заболевания ротовой полости, протекающие на фоне ВИЧ, часто переходят в хроническую форму.
Биопленки полости рта запускают хронические воспалительные реакции, которые обусловливают деструктивные процессы. Однако характерные особенности специфических реакций организма человека на биопленки плохо изучены.
Зубная биопленка — это мультивидовое микробное сообщество, формирующееся в условиях текучих сред (слюна, десневая и ротовая жидкость) со сложной структурной организацией, включающей полимерно-клеточный матрикс и микроколонии микробов, регулирующееся многочисленными сигнальными взаимодействиями по типу прямых и обратных связей на уровне рецепторов и сигнальных молекул [1].
При пародонтите во время активных фаз разрушения тканей пародонта десневая жидкость обычно содержит высокие уровни медиаторов, таких как провоспалительные цитокины, способствующих воспалению [2].
Цитокины — короткоживущие, небольшие (10—30 кДа) гликопротеины, продуцируемые de novo
в ответ на иммунные стимулы. Они опосредуют и регулируют иммунитет, воспаление, рост клеток, их дифференцировку и гемопоэз. Секретируются в основном лимфоцитами, моноцитами и макрофагами, но взаимодействуют с огромным числом клеток. Связываясь с рецепторами на клеточных мембранах, они запускают комплексы вторичных мессенжеров, которые переносят сигнал в ядро клетки; при этом меняется экспрессия многих генов. Цитокины являются мощными (функционирующими в наномолярных концентрациях), избыточными (многие из них индуцируют один и тот же ответ), плейотропными (отдельные цитокины индуцируют множественные реакции) веществами, действующими локально между соседними клетками. Они могут индуцировать синергичный (усиливая) или антагонистический (ослабляя) биологический ответ.
По мнению R. Medzhitov и C. Janeway, цитокины являются «молекулярными светофорами», регулирующими скорость и степень иммунных реакций [3].
Современные исследования указывают на то, что ответ десневых клеток различен в случае инфицирования полости рта (ПР) однородной биопленкой [4], многовидовыми биопленками [5] и планктонными бактериями [6].
В ПР обитают резиденты и патогены, которые поддерживают гомеостаз с эпителием [7]. Это может быть обусловлено тем, что система врожденного иммунитета высокоактивна в здоровых тканях. Нарушение баланса в этой системе может оказать воздействие на ткани пародонта [8].
Данные ряда зарубежных и отечественных исследователей позволяют выделить пародонтопатогенные виды 1-го порядка («красный комплекс») и 2-го порядка («оранжевый» и частично «желтый комплекс»), а также ряд видов, встречающихся в ПР постоянно, но количество которых резко возрастает при развитии пародонтита.
К пародонтопатогенам 1-го порядка относят Aggrega-tibacter actinomycetemcomitans, Porphyromonas
gingivalis
и
Tannerella forsythia
, доказана возможность их распространения в человеческой популяции по типу экзогенного инфекционного агента и выражена их тенденция к внутриклеточному паразитизму в десневом эпителии и тканях пародонта.
К пародонтопатогенам 2-го порядка относятся грам-отрицательные анаэробные бактерии Prevotella intermedia/nigrescens, Treponema denticola, Eykenella
corrodens, Fusobacterium nucleatum, Wollinella recta
, а также грамположительные —
Streptococcus intermedius, Parvimonas micra
и некоторые представители рода
Actinomyces
[9].
Биопленки и планктонные бактерии индуцируют разные сигнальные ответы
R. Peyyala и соавт. [4] разработали модели биопленок со Streptococcus sanguinis, Streptococcus oralis, Streptococcus gordonii, Actinomyces naeslundii, F. nucleatum
и
P. gingivalis
на твердых газопроницаемых контактных линзах. Биопленки и планктонные культуры инкубировали при анаэробных условиях с линией OKF4 эпителиальных клеток в течение 24 ч. При этом биопленки
P. gingivalis
значительно ингибировали продукцию онкогена, регулирующего рост (Gro-1α), интерлейкина (ИЛ) α, ИЛ-6, ИЛ-8, трансформирующего фактора роста-α (TGF-α), фракталкина (CX3CL1), макрофагального белка воспаления α (MIP α) и интерферон — α индуцибельного протеина 10 (IP-10). В целом биопленки всех видов бактерий ингибировали продукцию Gro-1α, TGF-α и фракталкина, тогда как биопленки
F. nucleatum
, напротив, стимулировали значительное увеличение продукции ИЛ-1α, ИЛ-6, ИЛ-8 и IP-10. Биопленки
A. naeslundii
также индуцировали повышенные уровни ИЛ-6, ИЛ-8 и IP-10. Планктонные стрептококки полости рта и в виде биопленки слабо стимулировали выделение любого из этих медиаторов эпителиальными клетками.
Увеличение количества медиаторов острого воспаления (например, ИЛ-8) усиливает рекрутирование нейтрофилов и потенцирует удаление любых внедрившихся микробов [10]. Биопленки P. gingivalis
индуцировали экспрессию генов ИЛ-8, тогда как секреция ИЛ-8 не коррелировала с экспрессией генов. Это можно объяснить тем, что бактерии выделяют гингипаины, ключевые факторы вирулентности
P. gingivalis
, оказывающие влияние на компоненты иммунной системы человека [11]. Поэтому авторы считают, что данная модель позволяет отличать биопленки от планктонных бактерий, патогенов и комменсалов [4].
R. McLaughlin и A. Hoogewerf [12] также представили доказательства того, что биопленки и планктонные бактерии по-разному реагируют на химические медиаторы. Так, биопленки Staphylococcus aureus
, обработанные 2 нг/мл ИЛ-1β в течение 6 ч, содержали в 2,5 раза больше клеток, чем необработанные биопленки. В планктонных культурах увеличения роста бактерий не наблюдалось. С помощью проточной цитометрии было показано
,
что ИЛ-1β связывался с 63% клеток биопленки, но только с 11% планктонных клеток. По-видимому, бактерии в биопленке ускользают от защитных реакций организма человека, размножаясь более быстро при выделении медиаторов воспаления активированными протективными клетками. S. Kanangat и соавт. [13] также показали, что рост биопленок
S. aureusin vitro
увеличивался в присутствии ИЛ-1β. Линейные пептидные фрагменты (<5 кДа) ИЛ-1β человека также усиливали их рост. Помимо этого, ИЛ модулировали экспрессию гена биопленок
S. aureus
. Они уменьшали экспрессию некоторых декодирующих токсины генов и повышали экспрессию генов, ответственных за прикрепление к тканям организма хозяина.
Результаты данных исследований показали, что биопленки и планктонные бактерии ПР индуцировали разные ответы. Более того, некоторые виды бактерий в биопленках обладали высокой стимулирующей активностью и при взаимодействии с рецепторами клеток организма индуцировали ответ, отличный от такового у отдельных бактерий.
Одновидовые биопленки более эффективно индуцировали секрецию ИЛ-8 эпителиальными клетками ПР, чем планктонные бактерии, за исключением P. gingivalis
[4, 14], особенно если они находились в составе 3-видовой биопленки.
Cпособность P. gingivalis
в планктонной форме ингибировать экспрессию генов ИЛ-8 эпителиальными клетками десен назвали «хемокиновым параличом» [15, 16].
Медиаторы, выделяемые в ответ на одновидовые и многовидовые биопленки
Известно, что A. actinomycetemcomitans
— единственный пародонтопатоген, который способен и распознавать, и связывать ИЛ-1β. У клинических штаммов этого вида наблюдался физиологический ответ на цитокины, выражавшийся в снижении метаболизма и увеличении массы биопленки [17]. Биопленки
A. actinomycetemcomitans
, культивируемые в модели органотипической слизистой десны, связывали ИЛ-1β, но использование антибиотиков во время их совместного культивирования ингибировало его связывание. Более того
A. actinomycetemcomitans
, по-видимому, поглощают ИЛ-1β, так как этот цитокин был обнаружен в межклеточном пространстве и цитоплазме этих бактерий [18]. Внутриклеточные протеины (трехмерная форма субъединицы β-синтазы аденозинтрифосфата и бактериальный подобный гистону протеин HU) могут взаимодействовать с ИЛ-1β человека [17, 18]. Взаимодействие интернализированного ИЛ-1β с ключевым протеином в выработке клеточной энергии и протеином HU, конденсирующим геномную ДНК, может объяснить описанные выше физиологические ответы
A. actinomycetemcomitans
. Эти результаты позволяют предположить, что жизнестойкие клетки
A. actinomycetemcomitans
обладают специфическим механизмом усваивания ИЛ-1β. В геноме
A. actinomycetemcomitans
закодирован липопротеин внешней мембраны, специфичный к
Pasteurellaceae
и ответственный за взаимодействие с ИЛ-1β [18]. При снижении жизнеспособности клеток в составе биопленок блокируется их способность связывать ИЛ-1β, что приводит к утечке ИЛ-1β в культуральную среду. В некоторых клетках
A. actinomycetemcomitans
ИЛ-1β локализуется во внешней кромке нуклеоида. Близкий контакт с живыми биопленками
A. actinomycetemcomitans
уменьшал пролиферацию и апоптоз десневых кератиноцитов человека. Авторы предполагают, что биопленки
A. actinomycetemcomitans
могут нарушать решающий первый этап локального воспаления при пародонтите, связывая и интернализируя ИЛ-1β [17].
Многовидовые биопленки обладают уникальными признаками, а в зависимости от видового состава они могут быть ассоциированы со здоровым пародонтом, гингивитом или пародонтитом, что было подтверждено при использовании сканирующей электронной микроскопии в сочетании с полимеразной цепной реакцией [19].
P. gingivalis, T.
forsythia
и
T. denticola
— пародонтопатогены так называемого «красного комплекса». Они ассоциированы с поддесневой биопленкой в участках повреждения при пародонтите. G. Belibasakis и соавт. [10] показали, что при культивировании многослойной органотипической культуры эпителиальных клеток человека с 10-видовой биопленкой — Campylobacter rectus (OMZ 697), F. nucleatum (OMZ 596), P. gingivalis ATCC 33277T (OMZ 925), P. intermedia ATCC 25611T (OMZ 278), T. forsythia OMZ1047, T. denticola ATCC 35405T (OMZ 661), Veillonella dispar ATCC 17748T (OMZ 493), Actinomyces oris (OMZ 745), Streptococcus anginosus (OMZ 871) и S. oralis SK 248 (OMZ 607)) или 7-видовой, в которой отсутствовали пародонтопатогены «красного комплекса», через 3 ч повышалась экспрессия генов ИЛ-8 одинаково независимо от видового состава биопленки. При добавлении пародонтопатогенов «красного комплекса» экспрессия генов ИЛ-8 увеличивалась в 3 раза. Через 24 ч секреция ИЛ-8 снижалась до 50% уровня в контрольных клетках, культивируемых на гидроксиапатите, обработанном слюной. Но это не происходило при отсутствии пародонтопатогенов «красного комплекса». Авторы пришли к выводу, что пародонтопатогены «красного комплекса» в составе биопленки по-разному регулируют хемотаксический ответ. Другие авторы также показали, что экспрессия ИЛ-8 индуцируется
T. denticola
,
P. gingivalis
,
T.forsythia
, а также их ассоциациями [20].
В 9-видовой системе без T. denticola
наблюдалось повышение секреции ИЛ-1, ИЛ-6 и ИЛ-8 через 4 ч и снижение через 24 ч [5].
Можно предположить, что как полимикробные ассоциации, так и P. gingivalis
,
T.denticola
и
T. forsythia
могут регулировать хемоаттрактантный ответ ИЛ-8 эпителиальных клеток, обладая потенциалом разрушения гомеостаза организма хозяина с микробом, возможно, в качестве стратегии манипулирования локальным ответом врожденной иммунной системы и повышения шанса их выживания в поддесневой нише.
Этим результатам соответствуют данные о том, что биопленки одного вида F. nucleatum
,
A. naeslundii
,
S.gordonii
и
S. oralis
также повышали экспрессию генов ИЛ-8 в эпителиальных клетках ПР через 6 ч культивирования
in vitro
, тогда как
S. sanguinis
не влияли, а
P. gingivalis
даже понижали их экспрессию [21].
Биопленка, состоящая из S.
gordonii
,
A. naeslundii
и
F. nucleatum
, индуцировала увеличение, а включающая
S. gordonii, F. nucleatum
и
P.gingivalis
— уменьшала секрецию ИЛ-8 [22]. Это может указывать на то, что
P. gingivalis
способны снижать хемоаттрактантный ответ эпителиальных клеток [10].
R. Peyyala и соавт. [22] выявили специфические медиаторы, уровень которых был значительно выше при стимуляции многовидовыми биопленками по сравнению с тем, которого можно было бы ожидать при простом аддитивном эффекте монобиопленок. Наконец, многие биопленки проявляют ингибирующее действие либо не изменяют нормальные фоновые уровни медиаторов, трансляции и секреции и (или) разрушают различные медиаторы в модельных системах биопленок. Это часто контрастирует с уровнями медиаторов, ожидаемыми при стимуляции монобиопленками или заражении планктонными бактериями [4].
В системе мультивидовых биопленок на гидроксиапатитных дисках, культивируемых с эпителиальными клетками, клетками периодонтальных связок или пульпы зубов, наблюдалось значительное увеличение апоптоза и деградации ИЛ-1β, ИЛ-6 и ИЛ-8. Биопленки, представленные некоторыми видами, значительно увеличивали содержание ряда медиаторов, тогда как биопленки P. gingivalis
оказывали противоположное действие даже на базальную продукцию цитокинов/хемокинов [5]. Кроме того, были выявлены гингипаины
P. gingivalis
инактивирующие фактор некроза опухоли (ФНО-α) [23].
Установлено, что биопленки, состоящие из S.
gordonii, S. oralis, S. sanguinis, F. nucleatum
и
P. gingivalis,
индуцируют более высокие уровни ИЛ-1α и проявляют синергичную стимулирующую активность по сравнению с аддитивным ответом 3 индивидуальных видов бактерий. Только биопленки
S. gordoni/A. naeslundii и A. naeslundii/F. nucleatum
индуцировали более высокие уровни секреции ИЛ-6, чем в контроле. При культивировании
с S.gordoni/A. naeslundii/F. nucleatum
первым секретировался ИЛ-8, хотя его уровень был не выше предполагаемого композиционного, индуцируемого монобиопленками [24].
Эпителиальные клетки распознают резидентные и патогенные микробы
Распознавание как резидентов, так и патогенов может инициировать врожденный иммунный ответ через толл-подобные рецепторы (ТЛР) [25]. E. Millhouse и соавт. [26] выявили четкие различия в ответе эпителиальных клеток после заражения комменсалами и патогенами. Эти данные согласуются с данными B. Dickinson и соавт. (2011) и Y. Hasegawa и соавт. (2007), которые изучали in vitro
реакции десневого эпителия на патогены и резиденты [27, 28]. Резиденты П.Р.
S. gordonii
, а также
F. nucleatum
индуцировали транскриптом эпителиальных клеток менее значительно по сравнению с пародонтопатогенами
P.gingivalis
и
A. actinomycetemcomitans
. Ограниченность этой работы была в том, что с эпителиальными клетками культивировали суспензию бактерий.
Другие исследователи также выявили разный ответ эпителиальных клеток (секрецию цитокинов и хемокинов) на биопленки патогенов и резидентов [4]. Они определили также меньший уровень продукции ИЛ-8 и ИЛ-1α на P. gingivalis
и
Streptococcus
spp
.
R. Peyyala и J. Ebersole считают, что способность разных видов бактерий в составе зубной биопленки индуцировать разный цитокиновый профиль эпителиальных клеток десны может отражать их индивидуальную вирулентность или статус резидента [6]. Так, P. gingivalis
индуцировали высокие уровни ИЛ-1β,
A. actinomycetemcomitans
— ИЛ-8,
F. nucleatum
— ИЛ-1β и ИЛ-6,
S. gordonii
вызывали минимальный хемокиновый ответ.
Все пародонтопатогены «красного комплекса» способны синергично колонизировать десневые эпителиальные клетки. Отмечена тенденция совместной локализации P. gingivalis
и
T. denticola.
При отсутствии пародонтопатогенов «красного комплекса» десневой эпителий колонизируют стрептококки, преимущественно
S. oralis
. Исходя из этого антагонизма, авторы полагают, что бактерии «красного комплекса» могут регулировать вирулентность биопленки, играющей роль в патогенезе пародонтита [29].
Биопленки смешанных патогенов и биопленки P. gingivalis
обладают огромным числом факторов вирулентности, которые могут индуцировать врожденный иммунный ответ.
P. gingivalis
контактируют с эпителиальными клетками с помощью фимбрий и гингипаинов и проникают в клетки [30]. Липополисахарид и его компонент липид, А
P. gingivalis
индуцируют сильный ответ иммунной системы человека, поскольку связываются с комплексом ТЛР, способствуя секреции провоспалительных цитокинов эпителиальными клетками и клетками других типов [31]. Гингипаины
P. gingivalis
разрушают цитокины и сеть цитокиновых рецепторов хозяина, включая ИЛ-1β, интер-ферон-γ (ИФН-γ) и ФНО-α [32].
Этим можно объяснить то, почему секреция данных цитокинов и хемокинов не коррелирует с экспрессией генов. Все эти факторы обусловливают патогенный потенциал P. gingivalis
. Эпителиальные клетки не полностью защищают организм хозяина от действия биопленки, содержащей пародонтопатогенные виды бактерий.
В серии элегантных экспериментов T. Maekawa и соавт. [33] показали, что P. gingivalis
ингибирует киллинг бактерий нейтрофилами и в то же время поддерживает сильный цитокиновый провоспалительный ответ. Эти процессы сопровождаются коактивацией ТЛР-2 и C5a-рецепторов нейтрофилов. Важно отметить, что данная работа дает доказательства, хотя бы на мышиной модели, того, что активация фосфатидилинозитол-3-киназы
P. gingivalis
не только усиливает собственную резистентность к фагоцитозу, но и другого ассоцианта дентальной биопленки —
F. nucleatum.
По данным С.С. Афанасьева и соавт. [34], ИЛ и ИФН способны реагировать непосредственно с микробами, изменяя скорость их роста и биологические свойства, в том числе чувствительность к антибактериальным препаратам. Так, установлено, что ФНО-α и ИФН-γ повышали чувствительность штаммов S. aureus, Enterobacter cloacae
и
Escherichia coli
к бензилпенициллину и тетрациклину, а ИФН-α2, наоборот, снижал чувствительность этих бактерий к антибиотикам, т. е. провоцировал устойчивость, блокируя даже совместное действие ФНО-α и ИФН-γ.
В настоящее время точно не известно, каким образом Streptococcus mitis
взаимодействуют с системой врожденного иммунитета. Ранее было показано, что
S. mitis
значительно толерантны к β-дефензинам-2 человека и другим антимикробным пептидам (АМП) [35, 36].
S. mitis
также могут модулировать экспрессию провоспалительного хемокина ИЛ-8 [37]. Исходя из этого, можно считать, что
S. mitis
в качестве полезного комменсала способны дополнять иммунитет хозяина, поддерживая тканевый гомеостаз.
Вирулентность Candida albicans
выше в зрелых смешанных многовидовых биопленках, культивируемых на реконструированных эпителиальных клетках человека (RHOE), чем в одновидовых биопленках. При этом наблюдается повышение секреции ИЛ-18, активности лактатдегидрогеназы и инвазивности
C. albicans.
В ответ на инфицирование
C. albicans
эпителиальные клетки ПР продуцируют большие количества ИЛ-6, ИЛ-8 и ФНО-α. Это указывает на то, что цитокины играют значительную роль в контроле инфекций ПР [38, 39]. После контакта с
Candida parapsilosis
гингивальные эпителиальные клетки человека экспрессируют высокие уровни мРНК ТЛР-2, ТЛР-4, но не ТЛР-9. Повышенным уровнем цитокинов и АМП можно объяснить ингибирование роста
C. parapsilosis
на эпителиальных клетках десен [40, 41].
Таким образом, все эти исследования показали, что эпителиальные клетки по-разному реагируют на патогены и комменсалы. Точный механизм этих процессов не полностью понятен.
Известно, что образование биопленок вносит значительный вклад в формирование у бактерий резистентности к антибиотикам и факторам врожденного иммунитета организма хозяина [42, 43]. Механизмы устойчивости биопленок к защитным реакциям организма могут включать изменения в экспрессии генов, которые обеспечивают реактивность к химическим медиаторам. Так как биопленки более похожи на рост бактерий in vivo
и участвуют в формировании инфекций, можно предположить, что они, но не планктонные клетки, должны были отвечать на цитокины.
Помимо разных видов бактерий, герпес-вирусы и дрожжевые грибы, обнаруживаемые в биопленках поддесневых областей, могут распознавать и связывать цитокины, вырабатываемые организмом хозяина [44].
Даже несмотря на то что в области изучения биопленок получены важные научные результаты, контроль биопленок остается все еще нерешенной проблемой и является центральным направлением современных исследований.
Таким образом, для системы врожденного иммунитета характерен дифференцированный цитокиновый ответ на бактерии ПР.
Значимость этих механизмов для широкой клинической практики определяет необходимость внедрения адекватных и надежных методов оценки компонентов систем ИЛ, дефензинов и их рецепторов, которые могут быть воспроизведены в условиях клинической лаборатории лечебно-профилактических учреждений.
Авторы заявляют об отсутствии конфликта интересов.
Рак полости рта
Рак полости рта чаще всего поражает язык, миндалины, десны и ротоглотку. Поскольку различные его виды часто не вызывают явных признаков и симптомов на ранних стадиях, регулярные стоматологические осмотры являются наиболее важным методом их выявления.
Ваш стоматолог также может проверить вас на наличие рака полости рта во время осмотра, особенно если у вас есть какие-либо из этих симптомов:
- Непроходящая боль во рту или губе;
- Красное или белое пятно во рту;
- Шатающиеся зубы;
- Болезненное глотание, постоянная боль во рту или ушах.
Лечение:
в зависимости от типа и стадии рака полости рта, лечение может включать в себя сочетание хирургического вмешательства, лучевой терапии и химиотерапии.
Стоматит
Это группа заболеваний, характеризующихся воспалением слизистой оболочки полости рта с гиперемией, отеком, увеличением количества слизи в ротовой полости. В зависимости от степени выраженности и глубины поражения в ротовой полости могут образовываться даже язвочки или очаги некроза, резко нарушающие общее состояние – повышенная температура, слабость, беспокойство, отказ от приема пищи.
Причин заболевания много: механические, химические, термические, бактериальные факторы. Нередко причиной заболевания в грудном возрасте служат загрязненные соски, игрушки и прочие предметы, которые попадают в рот ребенка. Часто стоматит развивается при инфекционных заболеваниях (корь, скарлатина, грипп, коклюш и др.) Слизистая оболочка полости рта приобретает ярко-красный цвет, становится отечной, на слизистой оболочке щек и языка видны отпечатки зубов. Слюна становится вязкой, тягучей. Слизистая оболочка покрывается беловатым налетом. Язык сухой, отечный, нередко с коричневым оттенком, жевание болезненно. Длительность заболевания от 1 до 3 недель, прогноз благоприятный.
Общим профилактическим правилом для детей и взрослых является соблюдение качественной гигиены ротовой полости.
Профилактика
Сохранить здоровье полости рта не сложно, если придерживаться простых рекомендаций:
- Питайтесь сбалансированно.
В рационе должно быть достаточное количество белковой пищи, а также продуктов, содержащих аминокислоты, микроэлементы и витамины. Углеводную еду, наоборот, лучше употреблять в небольших количествах.
- Тщательная гигиена ротовой полости.
Важно, например, использовать зубные нити и чистить зубы пастой или гелем дважды в день.
- Применение витаминов и пищевых добавок (по назначению врача).
Это позволит восполнить дефициты в организме, отражающиеся на здоровье рта.
- Регулярное посещение стоматолога.
К дантисту необходимо приходить на осмотр, по крайней мере, раз в год. Даже если нет никаких жалоб.
Краткие выводы
- Наиболее распространенные заболевания полости рта: кариес, болезни десен, инфекционные заболевания и рак полости рта.
- Кариес и болезни десен хорошо поддаются лечению на начальной стадии.
- Причины инфекционных заболеваний полости рта различны — от вирусов до неправильного питания и бесконтрольного приема лекарств.
- Для профилактики важно пересмотреть “гигиену жизни” и регулярно посещать стоматолога.
Семинары по антивозрастной медицине Получайте знания, основанные на доказательной медицине из первых уст ведущих мировых специалистов. В рамках Модульной Школы Anti-Age Expert каждый месяц проходят очные двухдневные семинары, где раскрываются тонкости anti-age медицины для врачей более 25 специальностей
Узнать подробнее