КЛАССИФИКАЦИЯ
Одонтогенные инфекции (инфекции полости рта), в зависимости от анатомической локализации, подразделяются на истинно одонтогенные
, связанные с поражением тканей зуба (кариес, пульпит);
пародонтальные
, связанные с поражением периодонта (периодонтит) и десны (гингивит, перикоронит), окружающих тканей (надкостницы, костной, мягких тканей лица и шеи, верхнечелюстного синуса, лимфоузлов);
неодонтогенные
, связанные с поражением слизистых оболочек (стоматит) и воспалением больших слюнных желез.
Данные виды инфекции могут быть причиной серьезных угрожающих жизни осложнений со стороны полости черепа, ретрофарингеальных, медиастинальных и других локализаций, а также диссеминированных гематогенным путем поражений клапанного аппарата сердца, сепсиса.
Гнойная инфекция лица и шеи
может быть неодонтогенного происхождения и включает фолликулит, фурункул, карбункул, лимфаденит, рожистое воспаление, гематогенный остеомиелит челюстей.
В челюстно-лицевой области также могут наблюдаться специфические инфекции (актиномикоз, туберкулез, сифилис, ВИЧ).
ОСНОВНЫЕ ВОЗБУДИТЕЛИ
Инфекции полости рта ассоциируются с постоянно присутствующей здесь микрофлорой. Обычно это смешанная флора, включающая более 3-5 микроорганизмов.
При истинно одонтогенной
инфекции, наряду с факультативными бактериями, прежде всего зеле-нящими стрептококками, в частности (
S.mutans, S.milleri
), выделяется анаэробная флора:
Peptostreptococcus
spp.,
Fusobacterium
spp.,
Actinomyces
spp.
При пародонтальной инфекции наиболее часто выделяют пять основных возбудителей: P.gingivalis, P.intermedia, E.corrodens, F.nucleatum, A.аctinomycetemcomitans
, реже
Capnocytophaga
spp.
В зависимости от локализации и тяжести инфекции, возраста пациента и сопутствующей патологии, возможны изменения в микробном спектре возбудителей. Так, тяжелые гнойные поражения ассоциируются с факультативной грамотрицательной флорой (Enterobacteriaceae
spp.) и
S.aureus
. У пациентов пожилого возраста и госпитализированных в стационар также преобладают
Enterobacteriaceae
spp.
В условиях отечественных бактериологических лабораторий достаточно сложно выделить специфического возбудителя определенной одонтогенной инфекции. Тем не менее, представляется возможным локализовать возбудителей, играющих основную роль в развитии инфекции полости рта, в наддесневом и поддесневом налете.
ПРИНЦИПЫ ЛЕЧЕНИЯ ИНФЕКЦИЙ ПОЛОСТИ РТА И ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ
Лечение одонтогенной инфекции
часто ограничивается местной терапией, включающей стандартные стоматологические манипуляции.
Системная антибактериальная терапия проводится только при распространении одонтогенной инфекции за пределы пародонта (под надкостницу, в кости, мягкие ткани лица и шеи), при наличии повышенной температуры тела, регионарного лимфаденита, интоксикации.
При выборе антимикробной терапии в условиях стационара, в случаях тяжелой гнойной инфекции, необходимо учитывать возможность присутствия резистентных штаммов среди таких анаэробов как Prevotella
spp.,
F.nucleatum
к пенициллину, что определяет назначение препаратов широкого спектра действия, амоксициллина/клавуланата в монотерапии или комбинации фторхинолона с метронидазолом. В связи с ростом уровня резистентности
Streptococcus
spp. к тетрациклину и эритромицину, данные препараты могут использоваться только как альтернативные. Так как отмечается умеренная активность метронидазола в отношении анаэробных кокков (
Peptostreptococcus
spp.), для повышения эффективности необходимо одновременное назначение β-лактамных антибиотиков.
Профилактическое системное применение АМП при выполнении стоматологических манипуляций в полости рта или периодонте не гарантирует уменьшения частоты инфекционных осложнений у соматически здоровых пациентов. Убедительных данных о достаточной эффективности местного применения антибиотиков при инфекциях полости рта не получено. В то же время бактерии полости рта являются резервуаром детерминант резистентности к АМП. Избыточное и неоправданное применение антибиотиков способствует их появлению и развитию резистентности патогенной микрофлоры.
ОДОНТОГЕННАЯ И ПАРОДОНТАЛЬНАЯ ИНФЕКЦИЯ
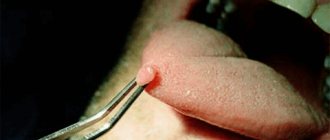
ПУЛЬПИТ
Основные возбудители
Зеленящие стрептококки (S.milleri
), неспорообразующие анаэробы:
Peptococcus
spp.,
Peptostreptococcus
spp.,
Actinomyces
spp.
Выбор антимикробных препаратов
Антимикробная терапия показана только в случае недостаточной эффективности стоматологических манипуляций или распространения инфекции в окружающие ткани (периодонт, периост и др.).
Препараты выбора
: феноксиметилпенициллин или пенициллин (в зависимости от тяжести течения).
Альтернативные препараты
: аминопенициллины (амоксициллин, ампициллин), ингибиторозащищенные пенициллины, цефаклор, клиндамицин, эритромицин + метронидазол.
Длительность применения
: в зависимости от тяжести течения (не менее 5 дней).
ПЕРИОДОНТИТ
Основные возбудители
В структуре периодонта микрофлора выявляется редко и обычно это S.sanguis, S.oralis, Actinomyces
spp.
При периодонтите у взрослых преобладают грамотрицательные анаэробы и спирохеты. P.gingivalis, B.forsythus, A.аctinomycetemcomitans и T.denticola
выделяются наиболее часто.
В ювенильном возрасте наблюдается быстрое вовлечение в процесс костной ткани, при этом обычными возбудителями являются A.аctinomycetemcomitans
и
Capnocytophaga
spp.
P.gingivalis
выделяется редко.
У пациентов с лейкемией и нейтропенией после химиотерапии наряду с A.actinomycetemcomitans
выделяется
C.micros
, а в препубертатном возрасте —
Fusobacterium
spp.
Выбор антимикробных препаратов
Препараты выбора
: доксициклин; амоксициллин/клавуланат.
Альтернативные препараты
: спирамицин + метронидазол, цефуроксим аксетил, цефаклор + метронидазол.
Длительность терапии
: 5-7 дней.
Пациентам с лейкемией или нейтропенией после химиотерапии применяются цефоперазон/сульбактам + аминогликозиды; пиперациллин/тазобактам или тикарциллин/клавуланат + аминогликозиды; имипенем, меропенем.
Длительность терапии
: в зависимости от тяжести течения, но не менее 10-14 дней.
ПЕРИОСТИТ И ОСТЕОМИЕЛИТ ЧЕЛЮСТЕЙ
Основные возбудители
При развитии одонтогенного периостита и остеомиелита в 50% случаев выделяется S.aureus
, а также
Streptococcus
spp., и, как правило, превалирует анаэробная флора:
P.niger, Peptostreptococcus
spp.,
Bacteroides
spp. Реже выявляются специфические возбудители:
A.israelii, T.pallidum
.
Травматический остеомиелит чаще обусловлен наличием S.aureus
, а также
Enterobacteriaceae
spp.,
P.aeruginosa
.
Выбор антимикробных препаратов
Препараты выбора
: оксациллин, цефазолин, ингибиторозащищенные пенициллины.
Альтернативные препараты
: линкозамиды, цефуроксим. При выделении
P.aeruginosa
— антисинегнойные препараты (цефтазидим, фторхинолоны).
Длительность терапии
: не менее 4 нед.
ОДОНТОГЕННЫЙ ВЕРХНЕЧЕЛЮСТНОЙ СИНУСИТ
Основные возбудители
Возбудителями одонтогенного верхнечелюстного синусита являются: неспорообразующие анаэробы — Peptostreptococcus
spp.,
Bacteroides
spp., а также
H.influenzae, S.pneumoniae
, реже
S.intermedius, M.сatarrhalis, S.pyogenes
. Выделение
S.aureus
из синуса характерно для нозокомиального синусита.
Выбор антимикробных препаратов
Препараты выбора
: амоксициллин/клавуланат. При нозокомиальной инфекции — ванкомицин.
Альтернативные препараты
: цефуроксим аксетил, ко-тримоксазол, ципрофлоксацин, хлорамфеникол.
Длительность терапии
: 10 дней.
ГНОЙНАЯ ИНФЕКЦИЯ МЯГКИХ ТКАНЕЙ ЛИЦА И ШЕИ
Основные возбудители
Гнойная одонтогенная инфекция мягких тканей лица и шеи, клетчатки глубоких фасциальных пространств ассоциируется с выделением полимикробной флоры: F.nucleatum
, пигментированными
Bacteroides, Peptostreptococcus
spp.,
Actinomyces
spp.,
Streptococcus
spp.
АБСЦЕССЫ, ФЛЕГМОНЫ ЛИЦА И ШЕИ
Основные возбудители
При абсцессе в области орбиты у взрослых выделяется смешанная флора: Peptostreptococcus
spp.,
Bacteroides
spp.,
Enterobacteriaceae
spp.,
Veillonella
spp.,
Streptococcus
spp.,
Staphylococcus
spp.,
Eikenella
spp.. У детей превалируют
Streptococcus
spp.,
Staphylococcus
spp.
Возбудителями абсцессов и флегмон неодонтогенного происхождения, чаще обусловленных мелкими повреждениями кожи, являются S.aureus, S.pyogenes
.
При гнилостно-некротической флегмоне дна полости рта выделяется полимикробная флора, включающая F.nucleatum, Bacteroides
spp.,
Peptostreptococcus
spp.,
Streptococcus
spp.,
Actinomyces
spp. Кроме названных, у пациентов с тяжелым течением могут быть выделены грамотрицательные бактерии и
S.aureus
(чаще у пациентов, страдающих сахарным диабетом и алкоголизмом).
Выбор антимикробных препаратов
Препараты выбора:
ингибиторозащищенные пенициллины (амоксициллин/клавуланат, ампициллин/сульбактам), цефоперазон/сульбактам.
При выделении P.aeruginosa
— цефтазидим + аминогликозиды.
Альтернативные препараты:
пенициллин или оксациллин + метронидазол, линкозамиды + аминогликозиды II-III поколения, карбапенемы, ванкомицин.
Длительность терапии:
не менее 10-14 дней.
БУККАЛЬНЫЙ ЦЕЛЛЮЛИТ
Основные возбудители
Обычно наблюдается у детей в возрасте до 3-5 лет. Основным возбудителем является H.influenzae
тип В и
S.pneumoniae
. У детей в возрасте до 2 лет
H.influenzae
— основной возбудитель, при этом, как правило, наблюдается бактериемия.
Выбор антимикробных препаратов
Препараты выбора
: амоксициллин/клавуланат, ампициллин/сульбактам, цефалоспорины III поколения (цефотаксим, цефтриаксон) в/в, в высоких дозах.
Альтернативные препараты
: хлорамфеникол, ко-тримоксазол.
Длительность терапии
: в зависимости от тяжести течения, но не менее 7-10 дней.
ЛИМФАДЕНИТ ЛИЦА И ШЕИ
Основные возбудители
Регионарный лимфаденит в области лица и шеи наблюдается при инфекции в полости рта и лица. Локализация лимфаденита в поднижнечелюстной области, по передней и задней поверхности шеи у детей в возрасте 1-4 лет, как правило, связана с вирусной инфекцией.
Абсцедирование лимфоузлов обычно обусловлено присоединением бактериальной инфекции. При одностороннем лимфадените по боковой поверхности шеи у детей старше 4 лет в 70-80% выделяются БГСА и S.aureus
. Анаэробные возбудители, такие как
Bacteroides
spp.,
Peptococcus
spp.,
Peptostreptococcus
spp.,
F.nucleatum, P.acnes
, могут быть причиной развития одонтогенного лимфаденита или воспалительных заболеваниях слизистой оболочки полости рта (гингивит, стоматит), целлюлита.
Выбор антимикробных препаратов
Препараты выбора: АМП, соответствующие этиологии первичного очага инфекции.
Чрезвычайная значимость инфекционной патологии в современном мире с его высокой мобильностью и экономической взаимозависимостью заключается в ее глобальной опасности для общественного здравоохранения каждой отдельно взятой страны и всего мирового сообщества в целом. Проведенная международными экспертами ВОЗ комплексная оценка рисков для здоровья населения, вызванных инфекционными агентами, позволила прийти к заключению, что нынешняя ситуация в мире далека от стабильности. Рост населения, стремительная урбанизация и глобализация, ухудшение состояния окружающей среды, быстрое внедрение в практику новых форм оказания медицинской помощи и необоснованное масштабное применение противомикробных препаратов привели к нарушению хрупкого равновесия в микробиологическом сообществе. На рубеже XX-XXI веков мы стали свидетелями беспрецедентных в истории темпов появления «новых» болезней (минимум по 1 нозологии в год!), распространения инфекционных болезней с атипичными клиническими проявлениями (25-57%) и «возвращающихся» инфекций (дифтерия, туберкулез, сифилис и др.), что, безусловно, и определило остроту проблемы инфекционной безопасности в современном мире [2, 22].
По нашему твердому убеждению, найти решение этой проблемы можно лишь сообща с привлечением специалистов из разных областей знаний. Ведь сущность инфекционной патологии как медицинской проблемы заключается не только в риске эпидемий и утяжелении течения острых инфекционных болезней. Сегодня ни для кого не секрет, что на первый план выходят длительно персистирующие инфекции со скудными клиническими проявлениями, возбудители которых выполняют этиологическую или триггерную роль в развитии гематологических, онкологических, неврологических, стоматологических заболеваний, поражения почек, печени, суставов и др. [7, 8, 12, 15-18, 21, 23]. Необходимость глубокого понимания вопросов инфекционной патологии и инфекционной безопасности врачами различных специализаций — насущная, жизненно важная проблема.
С этой точки зрения стоматологи занимают особую нишу, если учесть распространенность стоматологических заболеваний среди лиц всех возрастных групп (56-99% населения) и массовость обращений населения за стоматологической помощью. Уникальный количественный и качественный состав микрофлоры полости рта и интенсификация современной стоматологии чрезвычайно повышают риск перекрестного инфицирования пациентов и профессионального заражения медицинских работников. Достичь санитарно-эпидемиологического благополучия в медицинских стоматологических учреждениях поликлинического и стационарного уровня можно лишь объединив усилия стоматологов и инфекционистов в изучении инфекционно-ассоциированной патологии. Это в полной мере перекликается с утверждением American dental association (2012): «Стоматологическое обслуживание является неотъемлемым компонентом общего здравоохранения. Повышая качество стоматологических услуг, мы улучшаем общественное здоровье и благосостояние нации».
В настоящее время доля лиц с отягощенным преморбидным фоном среди пациентов стоматологов достигает 93,3%. Наиболее часто среди них встречаются лица с инфекционной патологией (острыми и хроническими гнойно-септическими заболеваниями, вирусными гепатитами, герпесвирусной инфекцией, ВИЧ-инфекцией, микозами и др.), пищевой и лекарственной аллергией, часто болеющие острыми респираторными вирусными инфекциями (ОРВИ) и пр. Причем в большинстве случаев пациенты даже не подозревают о наличии у них той или иной болезни, а в условиях временноݩго цейтнота стоматологического приема врачу получить исчерпывающую информацию о состоянии здоровья пациента крайне трудно. Следовательно, любой пациент, обратившийся за стоматологической помощью, должен рассматриваться врачом-стоматологом как представляющий эпидемиологическую опасность независимо от степени риска заражения!
По мнению участников совещания Неформальной сети по профилактике инфекций и инфекционному контролю в здравоохранении ВОЗ (2008), инфекции, связанные с оказанием медицинской помощи (ИСМП), представляют собой серьезную проблему общественного здравоохранения и значительное бремя для пациентов и медицинских работников, затрагивая все страны [6]. К ИСМП относится внутрибольничная инфекция (ВБИ), которую Европейское бюро ВОЗ определяет как «любое клинически выраженное инфекционное заболевание, которое поражает больного в результате его поступления в медицинское учреждение или обращения в него за лечебной помощью или сотрудников медицинского учреждения вследствие их работы в данном учреждении вне зависимости от появления симптомов заболевания во время или после пребывания в медицинском учреждении» [16].
Из основных групп ВБИ в стоматологии наиболее актуальны инфекции операционных ран и кровотока [6], развивающиеся в результате реализации гемоконтактного механизма передачи (через медицинские манипуляции) или контактного механизма, при котором возбудители, локализующиеся на коже и ее придатках, слизистой оболочке глаз, полости рта, поверхности ран одного пациента, инфицируют другого пациента при их прямом контакте или через обсемененные предметы госпитальной среды. Необходимо помнить о возможности перекрестного инфицирования пациентов и профессионального заражения медицинского персонала в результате реализации воздушно-капельного и контактного механизма передачи инфекции. Вероятные пути передачи инфекции от пациента к пациенту при стоматологических вмешательствах представлены в виде эпидемиологической цепочки (рис. 1, см. на цв. вклейке)
.
Рис. 1. Возможные пути передачи инфекции от пациента к пациенту при стоматологических вмешательствах.
К современным факторам, способствующим росту ВБИ в стоматологической практике, следует отнести:
— сложившуюся эпидемиологическую ситуацию по ВИЧ-инфекции, вирусным гепатитам, герпесвирусным инфекциям и др.;
— распространение потребления парентеральных психотропных препаратов;
— быстрый рост устойчивости микроорганизмов к противомикробным препаратам вплоть до мультирезистентности (например, M. tuberculosis
, грамотрицательные бактерии);
— распространение резистентных штаммов среди пациентов лечебно-профилактического учреждения в отсутствие эффективных программ инфекционного контроля;
— широкое использование инвазивных методов диагностики и лечения;
— создание крупных высокотехнологичных медицинских комплексов со специфической микроэкологией;
— трудности дезинфекции и стерилизации сложной медицинской аппаратуры;
— неблагополучная экологическая обстановка;
— увеличение среди пациентов числа лиц с проявлениями вторичного иммунодефицита.
Описаны экзогенные (первичные) и эндогенные (вторичные) источники инфицирования при стоматологических вмешательствах. При экзогенном инфицировании источником инфекции являются пациенты и медицинский персонал, инфицированные патогенными и условно-патогенными микроорганизмами. Под эндогенным инфицированием следует понимать активацию латентной инфекции под воздействием стрессовых воздействий (страх, обострение хронических заболеваний, ОРВИ и др.) и аутоинфицирование, этиологическими факторами которых в 85% случаев являются представители условно-патогенной флоры [1, 4].
Особого внимания заслуживает эндогенное инфицирование, легкость реализации которого объясняется чрезвычайно богатой аухтонной и аллохтонной микрофлорой слизистой, значительно варьирующейся у разных людей, а также у одного и того же человека в разное время. Представителями аухтонной микрофлоры являются резидентные микроорганизмы (от 160 до 300 видов; до 100 видов может быть выделено из 1 участка, из которых не менее 30 видов — постоянно живущие) и транзиторные микроорганизмы, состав которых зависит от факторов внешней среды (потребляемые продукты и вода, гигиенические процедуры и др.). Представители аллохтонной флоры попадают в полость рта из других микробиоценозов (из кишечника, носоглотки, дыхательных путей и др.). В результате исследований, проведенных в 2003 г. Л.П. Зуевой и соавт., было показано, что более 1/3 больных являются носителями Staphylococcus aureus
, 10% штаммов которого устойчивы к 5 и более антибактериальным препаратам
(рис. 2, см. на цв. вклейке)
.
Рис. 2. Представители микрофлоры полости рта, носа и зева, выявленные у пациентов, обратившихся за стоматологической помощью в отделение челюстно-лицевой хирургии. По результатам многолетних исследований J. Prieto-Prieto, A. Calvo и T. Kuriyama и соавт., в спектре одонтогенных бактерий среди анаэробов преобладают Peptostreptococcus, Prevotella
и
Fusobacterium
, среди аэробов —
Str. viridians(рис. 3, см. на цв. вклейке)
Рис. 3. Спектр одонтогенных бактерий (Kuriyama и соавт., 2002; Prieto-Prieto J., Calvo A., 2004). [13, 19]. По данным А.А. Зорькина и соавт. (2009), наиболее часто при воспалительных процессах в полости рта выявляют
Actinobacillus actinomycetemcomitans
и
Porphyromonas gingivalis
, реже —
Bacteroides forsythus, Prevotella intermedia, Prevotella nigrenscens, Fusobacterium
spp.,
Peptococcus micros, Carnocytophaga
spp.,
Treponema denticola, Treponema sokranskii
. Типичные возбудители одонтогенных инфекций —
Peptostreptococcus
spp.,
Peptococcus
spp.,
Fusobacterium
spp., инфекций пародонта —
A. actinomycetemcomitans, P. gingivalis, Pr. intermedia, Eikenella corrodens, Fusobacterium nucleatum
(особенно при тяжелых инфекциях).
Практикующим врачам важно помнить, что разнообразие микроорганизмов создает уникальные возможности для передачи детерминант вирулентности и резистентности, резервуаром которых является нормальная микрофлора [9, 20]. Описана возможность обмена генетической информацией между бактериями мочеполовых путей и полости рта, а в лабораторных условиях — между таксономически отдаленными видами микроорганизмов [9].
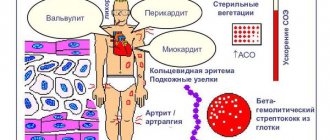
Инфекционные агенты тканей полости рта, от коммесалов до патогенов, играют этиологическую роль не только в запуске стоматологических заболеваний (кариеса, пародонтита, гингивита и др.). Нарушенная при стоматологических процедурах, травмах, инфекциях целостность барьера мягких тканей полости рта приводит к транзиторной бактериемии (фунгемия, виремия) и попаданию микроорганизмов в не свойственные им ткани (например, соединительную ткань, кровь), в результате чего индуцируются системные изменения экспрессии генов, приводящие к повышению вирулентности инфекционных агентов. Становясь эндогенными патогенами, микроорганизмы могут выполнять триггерную роль в формировании патологии пищеварительной, дыхательной, сердечно-сосудистой (ДВС-синдром, инфекционный эндокардит, атеросклероз) систем, ревматизма, нефропатии, многих инфекционно-аллергических состояний, аутоиммунных болезней (ревматоидный артрит — РА, болезнь Бехчета и др.) [10, 11, 20]. Так, доказано, что у S. sanguinis, S. oralis, S. mutans, S. salivarius
достаточно конститутивной экспрессии генов вирулентности, чтобы при попадании в кровоток индуцировать связывание тромбоцитами фибриногена, агрегацию и образование тромба, а при оседании на измененных или аномально развитых клапанах приводить к развитию инфекционного эндокардита. Изменение вирулентности может происходить под действием генов, регулируемых кислотностью среды, в которую попадают микроорганизмы. Так, при повышении pH до 7,3-7,5 у
S. gordonii
возрастает тромбиноподобная активность. При контакте с ламинином и коллагеном поврежденных клапанов сердца
S. gordonii
запускают экспрессию ламининсвязывающего белка, повышающего адгезию бактерий к поверхности клапана [11].
Интересен феномен бактериальной мимикрии у представителей микрофлоры полости рта. Так, сходство эпитопа белка клеточной стенки S. sanguinis
— PAAP, связанного с агрегацией тромбоцитов, с артритогенным эпитопом коллагена типа II, может быть одной из причин развития РА. Образуемый в норме у человека белок теплового шока (HSP60) высокогомологичен бактериальным HSP
Mycobacterium
(HSP65),
S. sanguinis
(HSP65),
Helicobacter pylori
(HSP60). Образующиеся антитела к ним перекрестно реагируют с развитием системной воспалительной реакции и через активацию системы комплемента приводят к иммунному воспалению в стенке сосудов, артриту, болезни Бехчета [14].
На долю инфекционных заболеваний, источником которых могут быть носители «классических» возбудителей (гепатитов, ВИЧ-инфекции, туберкулеза, сифилиса, герпес-вирусов и др.), приходится не более 15% от всей ВБИ медицинских учреждений стоматологического профиля. По данным ВОЗ (2007, 2010) [2, 6], среди всех инфекционных болезней для стоматологов и их пациентов наиболее актуальны вирусные гепатиты A, В, С, Д (TTV, G, SEN — ?), ВИЧ-инфекция, герпесвирусная инфекция, туберкулез, кандидозы, ОРВИ и грипп, корь, легионеллез, эпидемический паротит, стрептококковые болезни (ангина, скарлатина), стафилококковые (ангина, пневмония, энтероколит, гнойные поражения кожи и подкожной клетчатки и др.), дифтерия, сифилис, гонорея и столбняк. Основные инфекционные заболевания, имеющие клинические проявления в полости рта, представлены в таблице
.
Следует признать, что проявления даже хорошо известных инфекционных болезней могут меняться на фоне хронических заболеваний пациента или при ко-инфицировании, приобретая несвойственные им черты, что затрудняет их клиническую диагностику и требует своевременного лабораторного обследования.
Кроме представленных в таблице
инфекционных заболеваний, существует обширная группа вирусных инфекционных болезней, не имеющих характерных патологических проявлений в полости рта, но передающихся гемоконтактно при стоматологических вмешательствах, что ведет к развитию угрожающих жизни заболеваний пациентов и медицинского персонала (вирусный гепатит В, С, Д; цитомегаловирусная инфекция; Эпштейна-Барр вирусная инфекция — кроме описанных выше инфекционного мононуклеоза и опоясывающего герпеса; герпесвирусная инфекция, вызванная HHV-6, HHV-7, HHV-8 типом, и др.).
Все вышесказанное свидетельствует о большой роли инфекционных агентов в патологии человека в целом и в стоматологической практике, в частности. Врач-стоматолог в любой момент может встретиться с инфекционным больным. От его эрудиции и знаний нередко зависят жизнь пациента и своевременное пресечение эпидемического процесса, позволяющее предупредить перекрестное заражение и инфицирование медицинского персонала при оказании стоматологической помощи.
НЕОДОНТОГЕННАЯ И СПЕЦИФИЧЕСКАЯ ИНФЕКЦИЯ
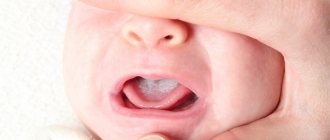
НЕКРОТИЧЕСКИЙ СТОМАТИТ (ЯЗВЕННО-НЕКРОТИЧЕСКИЙ ГИНГИВОСТОМАТИТ ВЕНСАНА)
Основные возбудители
В десневой бороздке концентрируются Fusobacterium
, пигментированные
Bacteroides
, анаэробные спирохеты. При некротическом стоматите имеется тенденция к быстрому распространению инфекции в окружающие ткани.
Возбудителями являются F.nucleatum, T.vinsentii, P.melaninogenica, P.gingivalis и P.intermedia
. У пациентов со СПИДом частым возбудителем гингивита является
C.rectus
.
Выбор антимикробных препаратов
Препараты выбора:
феноксиметилпенициллин, пенициллин.
Альтернативные препараты:
макролид + метронидазол.
Длительность терапии:
в зависимости от тяжести течения.
АКТИНОМИКОЗ
Основные возбудители
Основным возбудителем актиномикоза является A.israelii
, также возможна ассоциация с грамотрицательными бактериями
A.actinomycetemcomitans
и
H.aphrophilus
, которые устойчивы к пенициллину, но чувствительны к тетрациклинам.
Выбор антимикробных препаратов
Препараты выбора
: пенициллин в дозе 18-24 млн ЕД/сут, при положительной динамике — переход на ступенчатую терапию (феноксиметилпенициллин 2 г/сут или амоксициллин по 3-4 г/сут).
Альтернативные препараты
: доксициклин 0,2 г/сут, пероральные препараты — тетрациклин 3 г/сут, эритромицин 2 г/сут.
Длительность терапии
: пенициллин 3-6 нед в/в, препараты для приема внутрь — 6-12 мес.
Результаты
В 29 случаях (90,7%) результатом ОИ был гайморит, в 2 — небный абсцесс (6,2%) и абсцесс клыковой ямки (3,1%). Шейно-фасциальные пространства были задействованы следующим образом: подподбородочное пространство в 2 случаях (16.7%), подчелюстное в 7 случаях (58.3%), грудино-ключично-сосцевидная область в 2 случаях (16.7%), и окологлоточное с нисходящим распространением в средостение одном (8.3%).
Причины ОИ включали удаление зубов (7 случаев — 15,9% в целом), установку имплантатов (13 случаев — 29,6%), кариес (12 случаев — 27,3%), аномалии прорезывания (8 случаев — 18,2%), эндодонтические манипуляции (2 случая — 4,5%), а также синуслифтинг (2 случая -4,5%). Они также делятся на осложнения доимплантологического (2 случая — 4,5%) или имплантологического лечения (13 случаев — 29,6%), последствия «классических» стоматологических процедур (т. е. удаление зубов, эндодонтия), кариеса или аномалий прорезывания (29 случаев — 65,9%), согласно предложению классификации Фелисати [11].
Микробиологические посевы хирургических образцов были отрицательными в 5 случаях (11,4%) или демонстрировали неспецифический рост смешанной орофарингеальной флоры (ОФ) в 12 случаях (27,2%). Таким образом, антибиотикотерапия применялась у большинства пациентов. Три (6,8%) чисто микотических инфекции (Aspergillus spp) наблюдались как мицетомы верхнечелюстной пазухи.
Шейное хирургическое дренирование с удалением некротических тканей в сочетании с стоматологическими процедурами, направленными на устранение сопутствующих стоматологических патологий, применялось во всех случаях обнаружения орофарингеальной флоры (12 случаев). Рецидивирующая инфекция развилась в одном случае после хирургического вмешательства (т. е. парафарингеальный абсцесс как следствие длительного, нелеченного кариеса), с ретрофарингеальным и последующим нисходящим медиастинальным распространением. Пациенту потребовалась дополнительная торакотомия и длительное пребывание в отделении интенсивной терапии.
И наоборот, при ОИ верхнего отдела (32 пациента) доступ создавался через функциональный эндоскопический трансназальный доступ в 11 случаях (34,4%) или с помощью комбинации ФЭХ и доступом по Колдуэлл-Люку (18 случаев — 56,2%). Три верхних ОИ (два абсцесса твердого неба и один абсцесс клыковой ямки — 9,4%) были устранены трансоральным хирургическим дренированием без ФЭХ.